Pilhas ou Células Recarregáveis
A idéia de se recarregar uma célula ou bateria é simples: se passarmos pela substância fornecedora de energia uma corrente no sentido contrário àquela que ela fornece normalmente, a reação se inverte e a substância "absorve" a energia liberada, voltando à sua condição inicial.
A forma mais simples e mais tradicional de se fazer isso é com a bateria chumbo-ácido que é encontrada nos automóveis e que tem a estrutura mostrada na figura 4.
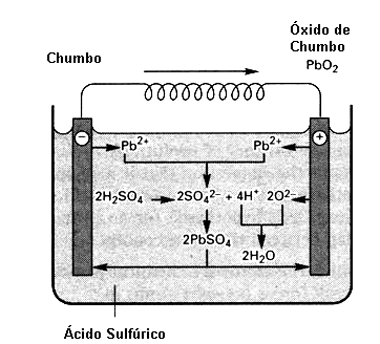
Nela temos duas placas de chumbo que formam seus pólos e o eletrólito é uma solução de ácido sulfúrico (ácido sulfúrico diluído em água). Cada par de placas fornece uma tensão de 2 V quando carregada, o que significa que uma bateria de carro de 12 V tem 6 pares deste tipo.
Quando a bateria está descarregada as duas placas são de chumbo puro. Ao se fazer circular uma corrente de carga nesta bateria, o ácido reage com uma das placas formando uma substância nova que é o óxido de chumbo que recobre a placa positiva. Esta substância contém a energia armazenada que a bateria pode fornecer depois numa reação química.
Quando uma carga é ligada à bateria, uma lâmpada, por exemplo, conforme mostra a figura 5, a corrente começa a circular pela lâmpada e pelo eletrólito na forma de íons, dando início a uma reação que começa a consumir a substância em que a energia está armazenada.
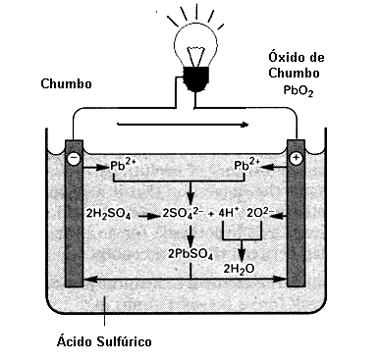
Esse fornecimento continua até o momento em que a substância armazenada na placa seja consumida totalmente, com o eletrodo de chumbo voltando à sua condição inicial.
Se uma corrente for agora forçada a circular no sentido inverso, a reação inversa ocorre, com a placa recompondo a substância com a energia disponível. Nos automóveis, o alternador fornece esta corrente de carga quando o motor está em funcionamento, recompondo continuamente a substância que fornece energia.
Outros tipos de células recarregáveis operam segundo o mesmo princípio, mudando apenas as substâncias envolvidas. Assim, nas células de Níquel-Cádmio ou Nicad, são estes os metais envolvidos no processo de reações, conforme mostra a estrutura de uma dessas células na figura 6.
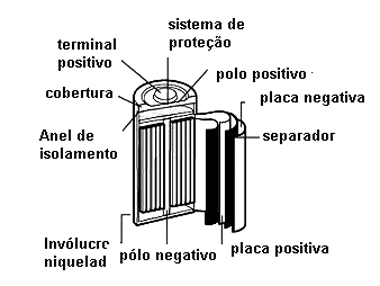
Veja que o número de vezes que uma célula pode ser recarregada, ou seja, o número de ciclos de carga e descarga não é ilimitado.
A substância usada como eletrólito com o tempo perde suas propriedades químicas e até mesmo os eletrodos podem sofrer desgastes e rupturas. Nas baterias de carro, por exemplo, o efeito da dilatação e contração que ocorre no processo de carga e descarga pode acabar por trincar as placas, tornando assim inoperante a bateria.
Todos que já tiveram um carro com baterias desses tipo, as que não são seladas do tipo antigo, onde era preciso completar com água destilada de tempos em tempos o nível do eletrólito, devem se lembrar do teste feito pelo eletricista de autos que, colocando uma forte carga na bateria para ela fornecer uma corrente intensa, fazia com que o eletrólito do par de placas danificadas fervesse.