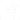Uma forma importante de se obter energia elétrica é a partir de baterias. As baterias, que são fontes químicas de energia elétrica, são empregadas numa série de situações na indústria, telecomunicações e em outros casos onde a energia normal de uma rede não alcança ou não está disponível num certo momento. No entanto, as baterias não são todas iguais. Dependendo da forma como devam ser usadas, se estacionárias ou móveis, da quantidade de energia que devem fornecer e por quanto tempo, existe o tipo específico a ser usado. Veja neste artigo como os diversos tipos de bateria operam e onde são usados. (2003)
Uma das formas mais utilizadas de se armazenar energia é a bateria. Desde sua invenção, a bateria passou por uma evolução constante, tanto para atender as exigências da tecnologia moderna como para torná-las mais eficientes e baratas.
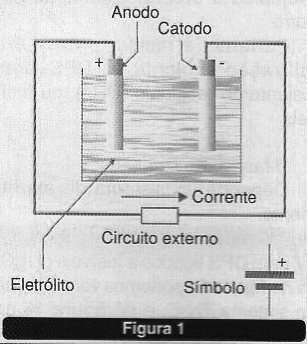
Assim, a partir de uma reação química de redução e oxidação que ocorram simultaneamente, pode-se obter um fluxo de elétrons e com isso energia elétrica.
Este é o princípio básico de operação das células ou baterias, onde uma substância é reduzida e outra oxidada e no processo a energia liberada pode ser aproveitada na forma de eletricidade.
As células podem ser classificadas em duas grandes categorias:
a) Primárias
Aquelas que já contém a energia a partir do momento em que são fabricadas, e não podem ser carregadas posteriormente. O processo químico de produção de energia ocorre a partir de uma reação irreversível.
b) Secundárias
Aquelas que, ao serem fabricadas, não dispõem de energia. Elas precisam ser carregadas e o ciclo de carga e descarga pode ser repetido um número elevado de vezes. A reação que ocorre nestas células é reversível. As células secundárias também são chamadas “acumuladores”.
As aplicações industriais dos dois tipos de células não se limitam ao fornecimento de energia em grande quantidade. Pequenas células podem ser necessárias para a alimentação de equipamentos de sensoriamento remoto, pequenas automações, e muito mais. Por outro lado, também devemos levar em conta as aplicações em que as baterias células devem ser de grande porte alimentando dispositivos de alta potência como inversores para um sistema de iluminação, um motor num sistema que não pode parar e muito mais.
Neste ponto é interessante diferenciarmos o que se denomina célula e bateria.
Conforme mostra a figura 1, a célula é a unidade de fornecimento de energia, constando de um par de eletrodos e uma substância ativa (eletrólito) que os interfaceia eletricamente.
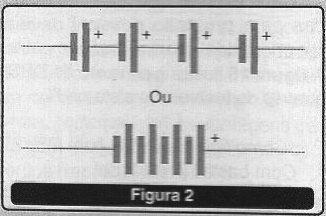
Quando associamos diversas células formamos uma bateria, conforme mostra a figura 2.
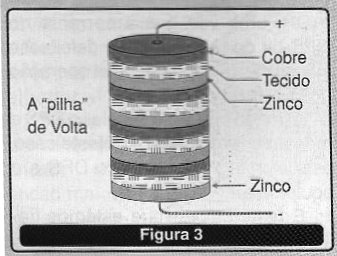
O conceito de pilha vem da “pilha” de volta que realmente era bateria de células primárias onde as diversas células, formadas por discos de cobre e zinco, eram “empilhadas”, conforme mostra a figura 3.
Desta forma, ficou o conceito de “pilha” para as pequenas unidades primárias que usamos em rádios, gravadores e outros equipamentos e o conceito de bateria para as unidades formadas pela associação dessas células, como as baterias de 9 V. O termo bateria também é empregado popularmente para designar as células secundárias que normalmente são fornecidas isoladamente ou associadas, conforme mostra a figura 4.
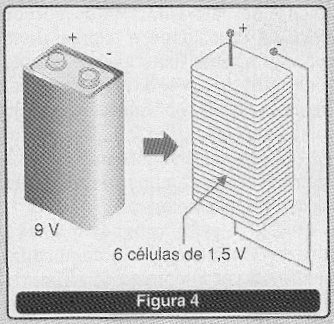
Neste artigo usaremos o termo “célula” para indicar a unidade geradora e bateria para a sua associação.
Veja que, neste artigo, estamos nos referindo apenas às baterias químicas já que podemos adotar os mesmos conceitos para baterias solares, baterias atômicas, etc.
Células Primárias
Os principais tipos de células primárias são:
a) Células secas
b) Células úmidas
c) Células de eletrólito sólido
d) Células de reserva
A célula de Leclanché
O tipo mais comum de célula em uso atualmente é a de Leclanché, nome dado em homenagem ao seu inventor em 1868.
Nesta célula, representada na figura 5, o eletrodo de anodo é o zinco que forma o invólucro externo, normalmente em forma de folha.
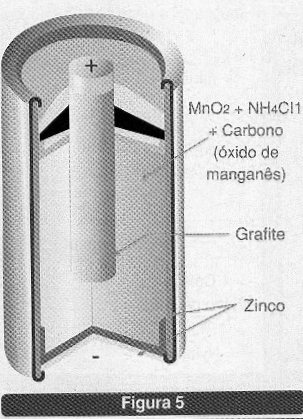
O eletrodo positivo é a solução de cloreto de zinco e cloreto de amônia que existe em seu interior na forma de uma pasta. Como eletrodo positivo ou anodo é usado um bastão de grafite. O eletrólito de catodo é formado por uma pasta de dióxido de manganês e carbono. As duas meia-células são separadas por uma barreira porosa.
As células deste tipo são vendidas tipicamente na forma de unidades cilíndricas que são as pilhas secas comuns ou na forma de baterias em que 3 a 4 unidades são associadas em série, conforme mostra a figura 6.
O método mais comum de fabricação é por extrusão, mas existe um método usado principalmente na China em que o zinco é forçado por um mandril estreito que faz seu alongamento na forma de um copo. O terceiro, também usado na china consiste em enrolar e soldar folhas de zinco para formar os copos.
Em muitas dessas células o zinco é amalgamado com mercúrio para aumentar a resistência à corrosão. Normalmente é usada uma proporção de 0,1% de mercúrio. Outro processo de aumentar a resistência do zinco à corrosão é pelo acréscimo do cádmio (0,05% tip) o que torna essas pilhas perigosas para o meio ambiente em caso de descarte. Alguns países possuem legislações que proíbem o uso de tais materiais tóxicos na fabricação das pilhas.
Os fabricantes mais conhecidos dessas pilhas são a Eveready Battery Company, Duracell International, Matsushita, Rayovac Co. e Varta.
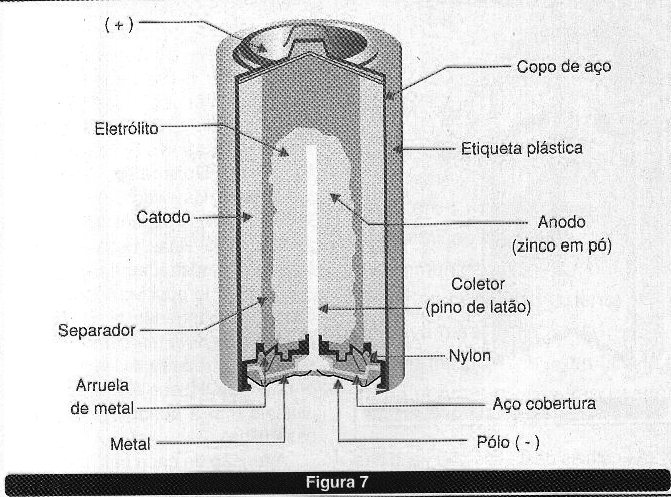
Neste grupo podemos incluir as células alcalinas. Essas pilhas têm a estrutura mostrada na figura 7.
O eletrodo positivo é formado por dioxido de manganês enquanto que o eletrodo negativo também é o zinco. A solução, entretanto é de hidroxido de potássio (KOH) que é uma substância alcalina (daí a denominação dada a esta pilha).
A tensão de cada célula e 1,5 V, e ela se caracteriza por ter maior capacidade de fornecimento de energia que as pilhas secas. Como as pilhas secas, as alcalinas não podem ser recarregadas, ou seja, as reações que liberam energia elétrica são irreversíveis.
Células Secundárias
O tipo mais comum de célula secundário em uso no mundo é a chumbo-ácido, devido sua aplicação nos automóveis. Em segundo lugar temos as células de níquel-cádmio (Nicad) e ferro-níquel (células de Edison).
Além dessas temos as células de brometo de zndo, sulfato de sódio, e outras que fazem uso do lítio como elemento básico.
Analisemos os principais tipos:
Bateria Chumbo-Ácido
Na figura 8 temos o princípio de operação deste tipo de bateria.
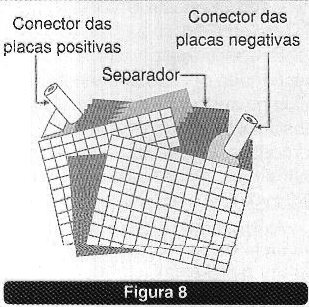
A metade da célula correspondente ao anodo é feita de chumbo ou uma grade de uma liga de chumbo. O eletrólito consiste em ácido sulfúrico diluído.
A metade correspondente ao catodo consiste em chumbo ou uma grade com uma liga de chumbo e dióxido de chumbo esponjoso sobre ela. O eletrólito também consiste em ácido sulfúrico diluído. As duas meias células são separadas por uma barreira porosa.
O chumbo do anodo, nas aplicações comerciais é obtido por métodos que permitem obter uma porcentagem de 40% desse elemento.
Aditivos como a água, ácido sulfúrico e outros como o sulfato de bário são adicionados para evitar a densificação do carbono poroso usado no processo devido aos ciclos de carga e descarga da célula. Densificação significa perder a porosidade e encolher o que pode causar deformação das placas.
A grade na qual as misturas do anodo e catodo são colocadas consiste numa liga de chumbo. Ligas de antimônio e arsênico são usadas, além de outros metais. O uso de ligas visa aumentar a resistência à corrosão e ao esforço mecânico.
Nas baterias com ciclos rápidos de carga e descarga 8% de antimônio é usado. Nas outras aplicações proporções de 1 a 3% são usadas.
O eletrólito usado nessas baterias é uma solução de ácido sulfúrico que deve ser livre de impurezas. A concentração normalmente é de 6 M, o que em termos comerciais significa uma densidade específica de 1,27 a 1,3.
A tabela abaixo mostra como as concentrações dependem tanto da aplicação da bateria como ao próprio clima do local em que ela deve funcionar.
Gravidade Específica
(clima tropical)
1,22 a 1,24
1,24 a 1,28
1,20 a 1,22
1,26 a 1,28
1,26 a 1,28
(*) Este termo refere-se a aplicação da bateria em uso automotivo e na partida de motores.
As barreiras que separam as duas metades da célula são normalmente feitas de celulose, polipropileno ou PVC .A porosidade é expressão em porcentagens ficando tipicamente entre 45% e 90% o que resulta em resistências especificas de 0,1 a 0,30 ohms/cm2.
As baterias chumbo-ácido encontram diversos campos de aplicação como:
• SLI e automotivas que são usadas em veículos de combustão interna no acionamento do motor de partida e mesmo na propulsão de veículos elétricos.
• Estacionárias, que são usadas com fontes auxiliares de energia.
• Portáteis, que são usadas na alimentação de equipamentos portáteis.
• Aeronaves e armazenamento renovável de energia
Células de Níquel Cádmio
Essas células podem ser encontradas numa grande variedade de configurações. As mais comuns são as baterias chatas de bolso e as de formato cilíndrico visando as mesmas aplicações das pilhas comuns.
A tecnologia de montagem depende da forma e tamanho da célula ou bateria, já que podemos encontrar desde os tipos botão e cilíndricas de pequenas dimensões até as chatas maiores usadas em celulares e outros equipamentos.
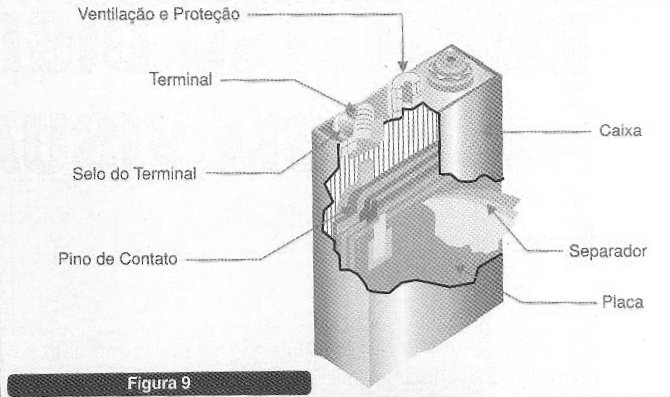
Para este tipo de bateria os eletrodos de anodo consistem numa mistura de cádmio com outras substâncias enquanto que o catodo consiste em hidróxido de níquel além de outras substâncias. Da mesma forma que nas baterias chumbo-ácido tanto o anodo como catodo estão imersos no mesmo eletrólito.
A substância usada neste caso é o hidróxido de potássio. Na figura 9 temos a construção típica de uma célula de Nicad típica.
Industrialmente o para o anodo temos o hidróxido de níquel e a grafite misturados. A grafite em pó entra numa proporção de 20% do material do eletrodo.
Para o catodo temos o hidróxido de cádmio, óxido de ferro, grafite e alguns aditivos orgânicos. O material entra no processo de fabricação na forma de pó. Por um processo de evaporação do cádmio é produzido óxido de cádmio o qual é convertido em hidróxido de cádmio por hidratação. Em determinado momento do processo oxido de ferro é adicionado e em seguida a grafite e os aditivos orgânicos.
Para o eletrólito a condutância máxima ocorre quando a solução tem uma densidade de 1,26 a 25 °C. Nas aplicações comerciais é adicionado hidróxido de lítio ao hidróxido de potássio numa concentração de 8 a 20 g.l com a finalidade de se evitar que o ferro contamine o catodo.
Aperfeiçoamentos
Uma exigência das aplicações modernas é que suas baterias tenham o mínimo de manutenção. Para isso, foram desenvolvidas tecnologias baseadas no uso de ciclos de recombinação de oxigênio para evitar a perda de água.
Outra tecnologia envolve novas arquiteturas para o material que envolve a bateria como, por exemplo, placas de fibras de níquel ou ainda placas de plástico ou borracha.
Célula de Edison ou Hidróxido de Níquel-Ferro
Trata-se de um tipo de célula secundário muito semelhante a célula de Níquel-Cádmio. A principal diferença está no fato do anodo ser ferro.
Esta célula foi patenteada em 1901 mas não teve o mesmo sucesso das baterias de Níquel-Cádmio devido as sua baixa capacidade de retenção de carga. A vantagem principal, entretanto, está no fato de que o ferro é mais barato que o cádmio e é muito menos tóxico.
Conclusão
As baterias têm passado por um desenvolvimento muito grande dado aumento de seu uso, principalmente nas aplicações portáteis.
Assim, como recentes desenvolvimentos temos as baterias de hidreto metálico, as baterias de lítio e as baterias de eletrólito sólido. As características dessas baterias, cada vez permitem a sua utilização em aplicações específicas.
| Aplicação | Gravidade Específica (clima temperado) |
| SLI (*) | 1,27 a 1,29 |
| Força Motora | 1,28 a 1,32 |
| Standby (carregada) | 1,22 a 1,24 |
| Standby (descarregada) | 1,27 a 1,30 |
| Aeronaves | 1,26 a 1,28 |