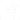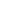Esta é uma das mais tradicionais experiências de Eletroquímica e pode ser feita com muita facilidade na versão original com ácido sulfúrico ou numa versão mais segura com água e sal. Outra possibilidade está na utilização de fontes alternativas de energia como, por exemplo a energia de painéis solares e do gelo.
Apenas um suporte de pilhas e um copo com a substância usada são necessários para demonstrarmos um importante fenômeno químico, que é a de composição da água ou ainda a obtenção de reações químicas a partir de correntes elétricas.
Esta é a versão original que pode ser utilizada num projeto para mostrar como hidrogênio pode ser produzido para alimentar motores elétricos de veículos em células a combustível, num excelente trabalho escolar. (veja o artigo Células a combustível 2 (ART933))
O que explicar:
Fazendo uma corrente elétrica circular por uma solução química, podemos ter reações que alteram as propriedades das substâncias envolvidas.
Se a corrente circular por um copo contendo água com um pouco de ácido sulfúrico dissolvido, por exemplo, a corrente decompõe a água e surgem bolhas dos seus elementos formadores nos fios elétricos.
No fio positivo surgem bolhas de oxigênio, ao mesmo tempo em que no fio negativo surgem bolhas de hidrogênio.
Procure nos livros a reação de decomposição da água e faça um cartaz explicativo.
Se a solução usada for água e sal, teremos uma reação diferente com o desprendimento de gases dos fios e ainda a mudança da coloração do líquido
que se torna azulado em função das reações que ocorrem com o cloro do cloreto de sódio (sal) e os metais dos fios.
Montagem:
Na figura 1 temos o esquema do aparelho e o aspecto real da montagem.
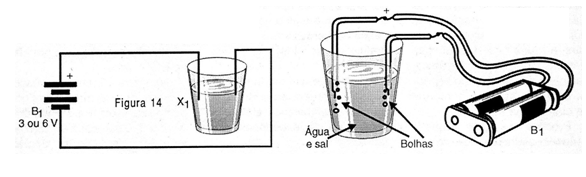
No copo enfiamos dois pedaços de fio sólido ou rígido comum dos quais tenhamos descascado aproximadamente 5 cm de suas pontas.
Soldamos as outras pontas nos fios do suporte de pilhas para garantir um bom contato.
Se for usada uma solução de ácido sulfúrico, peça ao professor de química que a forneça bem diluída e tenha muito cuidado ao usa-Ia.
Logo ao colocar as pilhas no suporte, deve começar a circulação da corrente com o aparecimento de bolhas e no caso da água e sal, em pouco tempo a solução se torna turva.
De tempos em tempos, no caso da água e sal, substitua a solução por uma nova.
Explorando o projeto
Mas, mesmo a fonte de energia pode ser modificada para que o trabalho se inclua numa modalidade mais completa que é o uso de fontes alternativas.
Assim, como primeira possibilidade temos a utilização de um conjunto de células solares na configuração mostrada na figura 2.
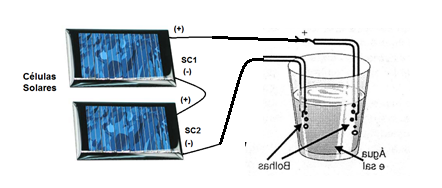
Bastará iluminar as células para que logo vejamos as bolhas de hidrogênio e oxigênio serem produzidas.
Esta tecnologia já é usada nos Estados Unidos, onde gigantescos painéis solares produzem hidrogênio para servir de combustível para veículos elétricos usando células a combustível. Veja o artigo no site, para fazer um trabalho completo. O artigo é Células a combustível 2 (ART933)
Para saber mais sobre a geração de energia solar sugerimos que seja consultado a Revista Mecatrônica Jovem - Edição 6 - Energias Alternativas
Outra possibilidade que pode resultar num excelente trabalho está na possibilidade de se produzir hidrogênio e oxigênio a partir de energia elétrica extraída do gelo.
No artigo O gelo que dá choque (DID009) mostramos como é possível obter energia elétrica do gelo, usando uma pastilha Peltier, do tipo que pode ser comprado pela Internet a um preço bastante acessível.
Essas pastilhas são usadas para “gerar frio” em pequenas adegas e refrigeradores, mas invertidas, podem gerar eletricidade a partir da fusão do gelo.
Na figura 3 temos o modo de se gerar energia para a eletrólise a partir da fusão de uma pequena pedra de gelo.
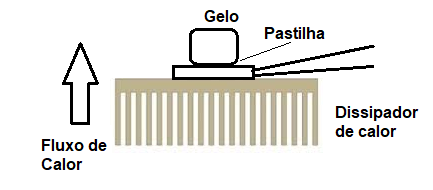
Ligando os fios da pastilha no copo com a solução indicada, ao se colocar a pedrinha de gelo sobre a pastilha logo veremos a produção das bolhas de hidrogênio e oxigênio subindo a partir das pontas dos fios.
Na figura 4 temos o aspecto de uma pastilha do tipo que pode ser usado no experimento.

Outras fontes alternativas podem ser utilizadas para se desenvolver um projeto. Podemos usar pequenos motores para simular dínamos em fontes eólicas ou hidráulicas, pilhas alternativas e muito mais.
Até mesmo a energia gerada pelo calor do corpo pode ser utilizada para gerar energia. Muitos artigos no site tratam de fontes alternativas de energia que podem ser exploradas.
Relatórios
É claro que os relatórios, slides ou cartazes são fundamentais se o experimento for usado com finalidade didática.
Os cálculos que envolvam estequiometria para se determinar a quantidade de hidrogênio e oxigênio produzidos são fundamentais num relatório.
Temos também no caso do gelo, o cálculo da quantidade de energia produzida pela fusão de uma determinada quantidade de gelo.
E, é claro em todos, a quantidade de cargas e a corrente gerada pelas fontes alternativas e a quantidade de gases liberada.
B1 - 3 ou 6 V - 2 ou 4 pilhas pequenas, médias ou grandes
X1 - Copo com solução – ver texto
Diversos:
Fios, suporte de pilhas, solda, etc.